siehe auch: Update – PARP-Inhibitoren und BRCA-Status
siehe auch: Neu – Erweiterte Zulassung von Olaparib beim Pankreaskarzinom
Gentest BRCA1 und BRCA2 bei Patientinnen mit Ovarialkarzinom
In Deutschland erkranken jährlich ca. 7.500 Frauen an einem Ovarialkarzinom, wovon etwa 3.000 die Kriterien eines rezidivierenden Platin-sensitiven High-grade serösen, epithelialen Ovarialkarzinoms (HGS-OC) erfüllen. Es wird angenommen, dass bei etwa 17% der Frauen mit einem HGS-OC eine Keimbahnmutation im BRCA1- oder BRCA2-Gen nachgewiesen werden kann. Etwa. 6% weisen auf den Tumor beschränkte somatische BRCA1/2-Mutationen auf.
Die Europäische Arzneimittel-Agentur (EMA) hat vor kurzem den oral einzunehmenden PARP-Inhibitor Olaparib (LynparzaTM der Firma Astra Zeneca) zur Therapie bei Patientinnen mit Ovarialkarzinomen zugelassen. Lynparza ist die erste zielgerichtete Erhaltungs-Monotherapie beim Ovarialkarzinom mit BRCA-Mutation.
Kriterien für eine Therapie mit Olaparib:
- Vorliegen eines “High-grade serösen, epithelialen Ovarialkarzinoms” (HGS-OC)
- Rezidiv eines Platin-sensitiven Ovarialkarzinoms mit somatischer oder Keimbahnmutation von BRCA1 oder BRCA2
Vor Beginn einer Behandlung mit Lynparza muss eine Bestätigung vorliegen, dass die Patientin eine BRCA-Mutation im Blut und/oder im Tumorgewebe aufweist. (Bild: Time line Lynparza – AstraZeneca)
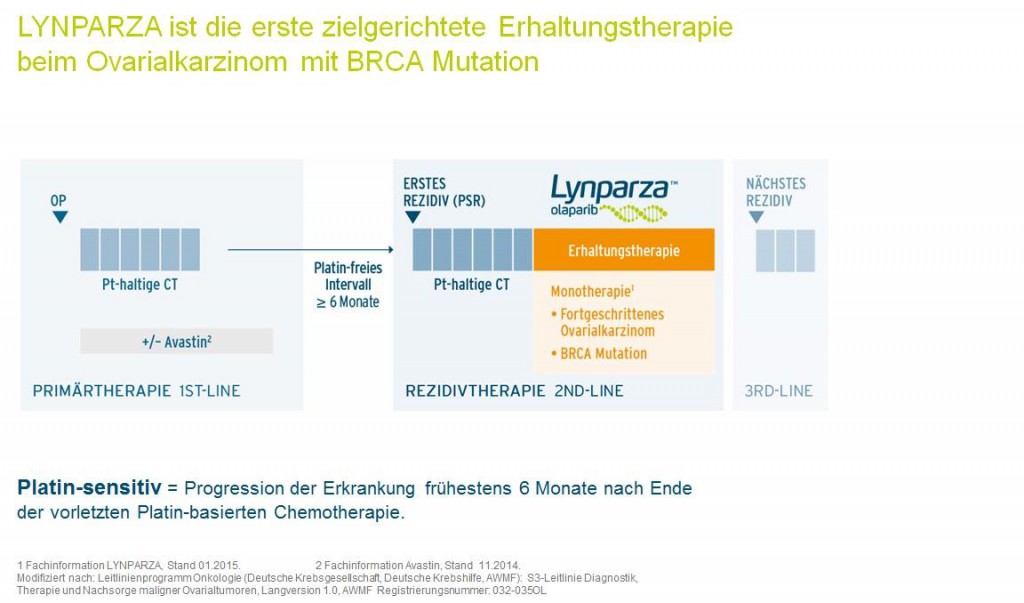 2015 wurde das Medikament Lynparza® (= Wirkstoff: Olaparib) von der Firma Astra Zeneca zur Behandlung des Ovarialkarzinoms zugelassen. Lynparza ist zugelassen für die Erhaltungstherapie bei erwachsenen Patienten mit einem Platin empfindlichen Rezidiv eines Platin empfindlichen hochgradigen serösen („high grade serös“) epithelialen Eierstock-, Eileiter (Tuba uterina) – oder primären Bauchfellkrebses (Peritoneums). Die tägliche Dosis beträgt 2x 400 mg (je 8 Kapseln). Voraussetzung für eine Wirksamkeit des Medikamentes ist der Nachweis einer Mutation im BRCA1- oder BRCA2-Gen im Tumorgewebe des Ovarialkarzinoms oder/und im Blut der betroffenen Frau. Die Analyse im Tumorgewebe zum Nachweis somatischer Mutationen ist nach dem Gendiagnostikgesetz auch ohne vorherige genetische Beratung möglich.
2015 wurde das Medikament Lynparza® (= Wirkstoff: Olaparib) von der Firma Astra Zeneca zur Behandlung des Ovarialkarzinoms zugelassen. Lynparza ist zugelassen für die Erhaltungstherapie bei erwachsenen Patienten mit einem Platin empfindlichen Rezidiv eines Platin empfindlichen hochgradigen serösen („high grade serös“) epithelialen Eierstock-, Eileiter (Tuba uterina) – oder primären Bauchfellkrebses (Peritoneums). Die tägliche Dosis beträgt 2x 400 mg (je 8 Kapseln). Voraussetzung für eine Wirksamkeit des Medikamentes ist der Nachweis einer Mutation im BRCA1- oder BRCA2-Gen im Tumorgewebe des Ovarialkarzinoms oder/und im Blut der betroffenen Frau. Die Analyse im Tumorgewebe zum Nachweis somatischer Mutationen ist nach dem Gendiagnostikgesetz auch ohne vorherige genetische Beratung möglich.
Lynparza wird von den meisten behandelten Frauen gut vertragen. Mögliche Nebenwirkungen sind Müdigkeit, Übelkeit, Erbrechen, Durchfall oder Blutarmut. Bei einer kleinen Anzahl von Patientinnen, die Lynparza allein oder in Kombination mit anderen Arzneimitteln gegen Krebserkrankungen erhielten, wurde vom Auftreten eines myelodysplastisches Syndroms/einer akuten myeloischen Leukämie (MDS/AML) berichtet. Die Behandlung mit Lynparza wird spätestens 8 Wochen nach Abschluss der letzten Dosis der platinbasierten Chemotherapie eingeleitet. Die Platin haltige Chemotherapie muss erfolgreich gewesen sein, d.h. die Erkrankung darf über einem Zeitraum von mindestens 6 Monaten nach der Chemotherapie nicht fortgeschritten ist.
Olaparib blockiert das Enzym Poly-ADP-Ribose-Polymerase (PARP), das an der DNA-Reparatur beteiligt ist. Durch die Hemmung der PARP-Proteine kann die beschädigte DNA in den Krebszellen nicht repariert werden. Das Ovarialkarzinom verliert, vereinfacht dargestellt, an genetischer Stabilität und es kommt zum Zelltod der Krebszellen. Signifikant zeigte Lynparza allerdings seine Wirkung nur bei Patientinnen, deren Tumoren Mutationen in einem BRCA-Gen aufwiesen. Eine genetische Testung auf BRCA-Mutationen bei Patientinnen mit Eierstockkrebs ist daher essentiell, um die Gruppe von Patientinnen zu identifizieren, welche von PARP-Inhibitoren profitieren könnten.
Diagnostisches Vorgehen für die genetische Analyse der Gene BRCA1 und BRCA2:
- Erhebung der Familienanamnese bei Frauen mit HGS-OC
- bei familiärem Vorkommen von Brust- und Eierstockkrebs – Gentest BRCA1/2 an einer Blutprobe
- bei unauffälliger Familienanamnese – Gentest BRCA1/2 an Tumorgewebe
- Verifikation der pathogenen BRCA-Mutation aus Tumor-DNA an einer Blutprobe
Weitere Informationen zur molekulargenetischen Diagnostik (Gentest) bei familiärem Mamma- und Ovarialkarzinom finden Sie hier und über die Möglichkeiten einer genetischen Beratung bei erblichem Eierstockkrebs können Sie sich hier informieren.
[gview file=“http://www.dna-diagnostik.hamburg/wp-content/uploads/2015/06/Olaparib-EMA.pdf“]
[gview file=“http://www.dna-diagnostik.hamburg/wp-content/uploads/2015/06/2015_03_26_GfH-Olaparib-Stellungnahme.pdf“]

